新的 USP 232 将于2018年开始执行!
近年来,药物的杂质残留,越来越受到医药界的关注,不仅仅是由于某些杂质具有毒性,而且这些杂质会对药品的稳定性、有效期限,产生不利的影响,甚至引发有害的副作用。因此,美国食药属 (FDA) 决定修改ICH Q3D和USP通则232和233章中的内容,强制业者对药品生产所用的原料药、中间体、活性成分(API)、赋形剂(稳定剂、填充剂、粘结剂、着色剂、调味剂、糖衣)、以及最终药物产品中所含的有机和无机(元素)杂质进行监测和控制。对于生产过程中可能混入的杂质,如催化剂和来自制药设备的杂质污染物,同样也必须进行监测。新的法规,将于2018年生效,业者必须尽早于今年建立新的品管检验标准。
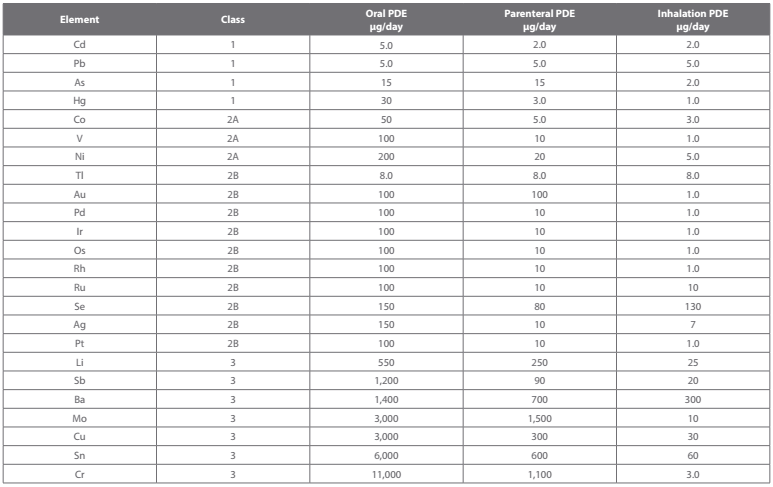
目前,USP <232> 章,已经完全采用ICH Q3D第4步指南 (ICH Q3D Step 4 Guideline),规范了药品、药物、活性成分、原料药中24种杂质的容许上限。此外,还定义了每日允许暴露量 (PDE, Permitted Daily Exposure),以 ug/day 定义三种主要药物递输类别的规范。
这些杂质或许是天然存在,或是从生产催化剂而来,或是无意中通在制造过程污染,也可能是制药原料中的环境污染物。当已知的杂质有潜在的可能性时,其含量必须低于规定的上限。此外,由于重金属,砷,镉,铅,汞,已知普遍的危害性,因此这四个元素,必须被严格监测。而其他元素杂质,除非单独存在于某药物的规范中另有规定,其他状况,则必须符合规范中提及的原则与上限,并且必须向主管机关提供检测结果。
全部24种元素杂质的各别含量,如下表所示:
势动科技代理美国 SPEX Certiprep 高品质标准品,提供您 AssuranceR 等级,高可靠度的标准物质。所有产品均有可追溯认证,可用于检验认证。
跟他牌标准品不同的是,所有的 SPEX CertiPrep 标准品类别,均通过 ISO Guide 34 认证,可靠度 100% 保证。
SPEX CertiPrep 的药检专用标准品 (USP ICH Pharmaceutical),让让您与美国的新规范无缝接轨。以最少的成本,符合新的标准,并且拿到最具公信力的检测认证。
注:关于 USP <232> 的最新规范,请以美国 FDA 的公告为准。以上说明为SPEX Certiprep 产品 DM 文件内容,文章并没有随 FDA 最新公告持续更新。关于本文,势动科技不负校正、更新与传达之责任,请斟酌参考。


